Camilia®
Solution buvable en récipient unidose
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Adressez-vous à votre pharmacien pour tout conseil ou information.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
- Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
Que contient cette notice ?
- Qu'est-ce que CAMILIA®, solution buvable en récipient unidose et dans quels cas est-il utilisé ?
- Quelles sont les informations à connaître avant de prendre CAMILIA®, solution buvable en récipient unidose ?
- Comment prendre CAMILIA®, solution buvable en récipient unidose ?
- Quels sont les effets indésirables éventuels ?
- Comment conserver CAMILIA®, solution buvable en récipient unidose ?
- Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CAMILIA, solution buvable en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Médicament homéopathique.
CAMILIA, solution buvable en récipient unidose est un médicament homéopathique traditionnellement utilisé dans les troubles attribués à la poussée dentaire (douleurs et rougeurs des gencives, hypersalivation, irritabilité …) chez le nourrisson.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE CAMILIA, solution buvable en récipient unidose ?
Ne prenez jamais CAMILIA, solution buvable en récipient unidose :
• si vous êtes allergique aux substances actives.
Avertissements et précautions
NE PAS INSTILLER DANS L’ŒIL, NI DANS L’OREILLE.
NE PAS INJECTER.
Enfants
Sans objet.
Autres médicaments et CAMILIA, solution buvable en récipient unidose
Informez votre médecin ou pharmacien si votre enfant prend ou a pris récemment tout autre médicament.
CAMILIA, solution buvable en récipient unidose avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
CAMILIA, solution buvable en récipient unidose contient
Sans objet.
3. COMMENT PRENDRE CAMILIA, solution buvable en récipient unidose ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
3 à 6 unidoses par 24 heures durant 3 à 8 jours.
Si les symptômes persistent au-delà de 3 jours, s’assurer auprès d’un professionnel de santé qu’ils relèvent d’une poussée dentaire.
Voie orale.
• Se laver les mains avant d’utiliser les unidoses.
• Ne pas conserver un récipient unidose après ouverture. Le récipient unidose doit être jeté après chaque usage.
1. Ouvrir le sachet aluminium
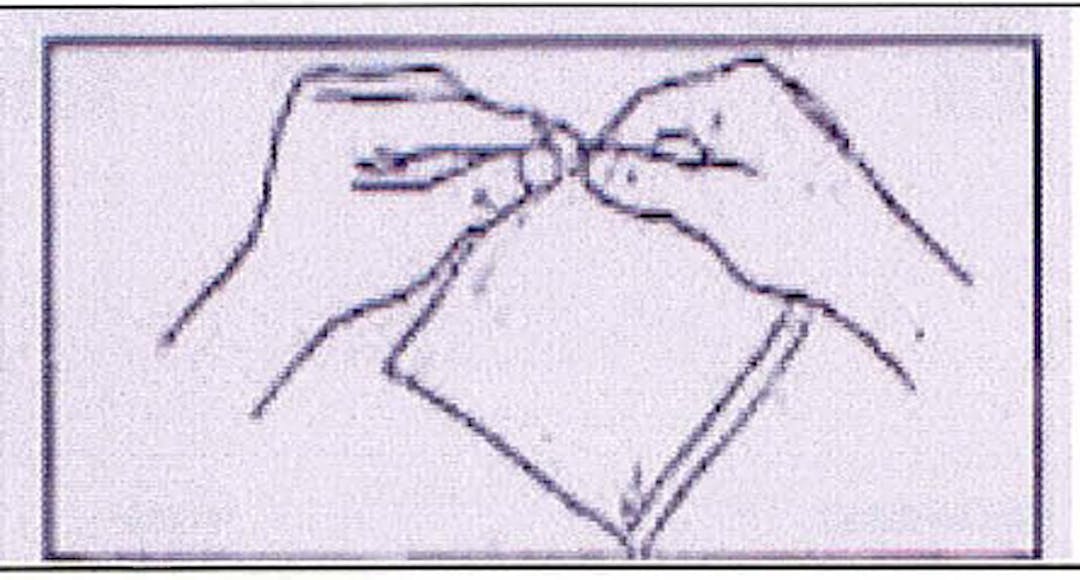
2. Détacher un récipient unidose de la barrette
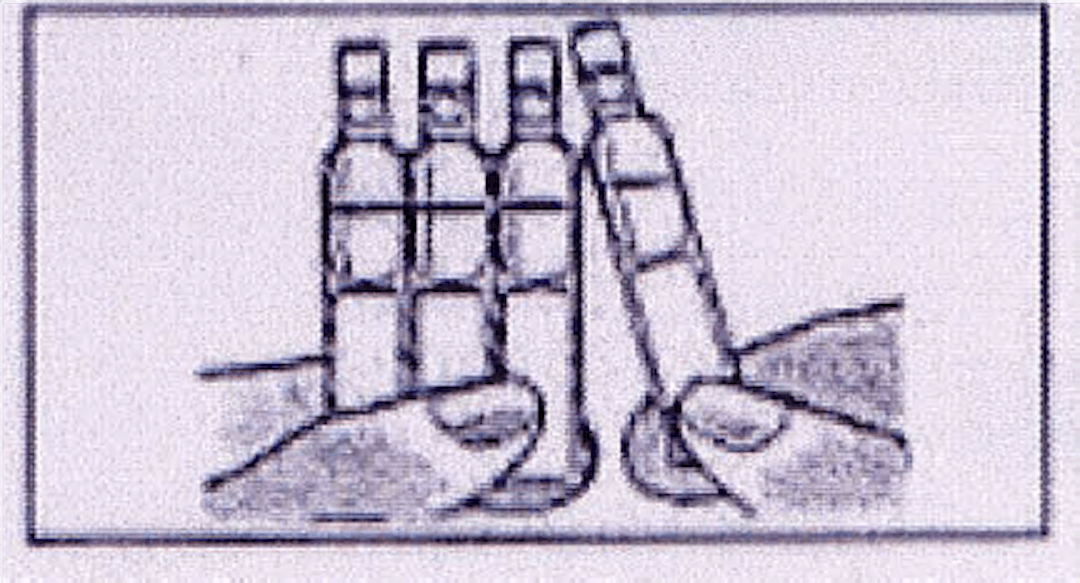
3. Ouvrir le récipient unidose en tournant l’embout
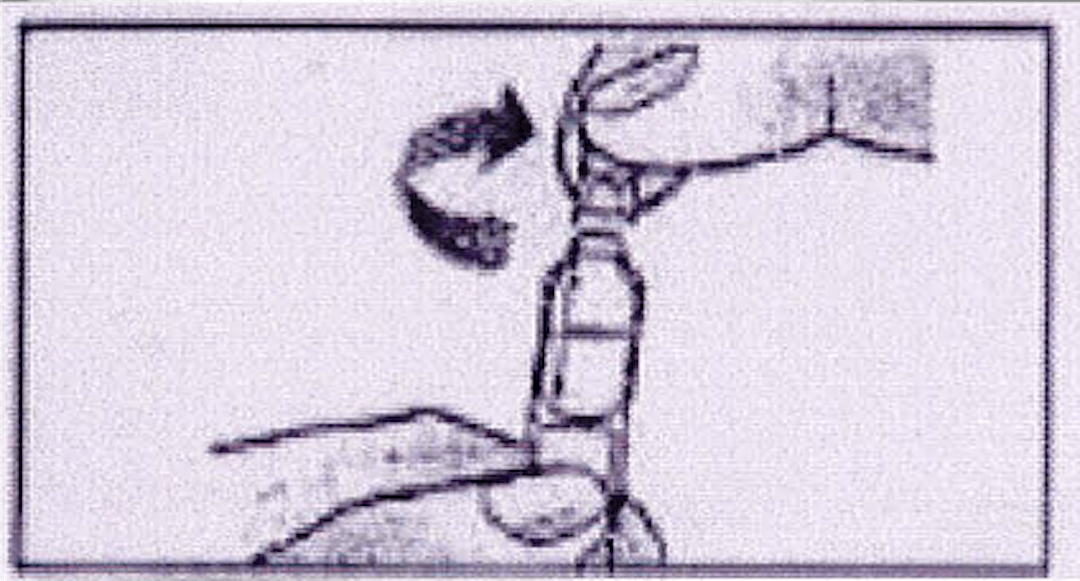
4. Mettre l’enfant en position assise. Verser le contenu du récipient unidose en pressant légèrement dessus, dans la bouche de l’enfant.

5. Fermer soigneusement le sachet contenant les autres récipients unidoses en repliant le côté ouvert.
Afin d’administrer une solution toujours stérile, utiliser un nouveau récipient unidose lors de chaque utilisation.
Si vous avez donné plus de CAMILIA, solution buvable en récipient unidose que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de donner CAMILIA, solution buvable en récipient unidose
Ne donnez pas de dose double pour compenser la dose simple que vous avez oublié de donner.
Si vous arrêtez de donner CAMILIA, solution buvable en récipient unidose
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CAMILIA, solution buvable en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour du mois.
Avant ouverture du sachet : pas de précautions particulières de conservation.
Après ouverture du sachet : conserver les récipients unidoses non utilisés dans le sachet.
Après ouverture du récipient unidose :
- Le produit doit être utilisé immédiatement.
- Jeter le récipient unidose après utilisation.
- Ne pas le conserver pour une utilisation ultérieure.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CAMILIA, solution buvable en récipient unidose
- Les substances actives sont :
Chamomilla vulgaris 9 CH.................333,3 mg
Phytolacca decandra 5 CH................333,3 mg
Rheum 5 CH....................................................333,3 mg
Pour un récipient unidose de 1 ml.
- L’autre composant est :
L’eau purifiée.
Qu’est-ce que CAMILIA, solution buvable en récipient unidose et contenu de l’emballage extérieur ?
Ce médicament se présente sous forme de solution buvable en récipients unidoses de 1 ml. Boîte de 10 récipients unidoses ou boîte de 30 récipients unidoses.
Titulaire de l’autorisation de mise sur le marché
BOIRON
2 avenue de l’Ouest Lyonnais
69510 MESSIMY
FRANCE
Exploitant de l’autorisation de mise sur le marché
BOIRON
2 avenue de l’Ouest Lyonnais
69510 MESSIMY
FRANCE
Fabricant
BOIRON
ZAC des Frenes
1 rue Edouard Buffard
77144 MONTEVRAIN
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
Juillet 2022
Autres
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).